Dans cet article, nous explorerons le pH et l’acidité, ce qu’ils signifient pour une plante et pour l’environnement de croissance. D’abord, penchons-nous sur ce que sont l’acidité et le pH.
Qu'est-ce que l’acidité?
L'acidité est essentielle à la vie sur Terre. Elle détermine les caractéristiques, la qualité, la capacité d’absorption et la solubilité de nombreuses substances. C’est de cette façon que travaillent les enzymes qui sont responsables de presque tous les processus biologiques des organismes, mais seulement au bon taux d’acidité1. Une petite fluctuation de l’acidité dans le sang cause la mort.
Qu'est-ce que le pH?
Le pH (pondus Hydrogenii) indique l’acidité ou l’alcalinité d’une solution2. La valeur du pH varie généralement de 0 à 14. Une solution ayant un pH entre 0 et 7 est dite acide, alors qu’une solution au pH entre 7 et 14 est dite alcaline. Le vinaigre et le cola ont un pH inférieur à 3. Le soda et le savon ont un pH supérieur à 8. Un pH de 7 est considéré neutre. De l’eau pure à la température ambiante a un pH de 7. Le pH de l’eau du robinet est généralement un peu plus élevé, à cause de la présence de calcium.
De nombreux environnements naturels, comme notre peau, les substrats pour les plantes et les milieux nutritifs, sont légèrement acides et ont un pH entre 5 et 6,5. Les choses que les gens aiment sont généralement légèrement acides ou neutres, comme l’eau. Les plantes aussi préfèrent les substances légèrement acides. Une valeur de pH de 5,5 se trouve si souvent dans la nature que certains experts considèrent cette valeur comme neutre.
Pourquoi l’acidité est-elle importante?
L’acidité a une influence substantielle sur l'absorbabilité et la solubilité de nombreux éléments nutritifs (voir figure 1).
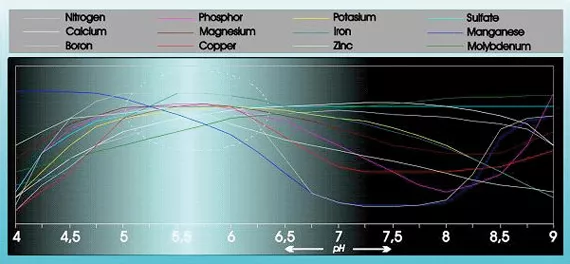
De plus, l’acidité a une influence considérable sur la structure, la dégradation des substances organiques et la vie microscopique dans le sol. Le pH influence également la façon dont les éléments nutritifs, les métaux lourds et les pesticides sont lessivés du sol.
Une valeur de pH trop basse ou trop élevée peut endommager vos plantes: il est important de l’ajuster correctement. Comment savoir quand le pH est erroné ? Avec l’expérience ! Pour vous aider, voici certains des symptômes que vous pourriez observer:
Symptômes d’un pH trop bas (substrat trop acide):
- La plupart des nutriments peuvent être dissouts facilement, ce qui peut causer un excès de manganèse, d’aluminium et de fer;
- Des carences en phosphore, en potassium, en magnésium et en molybdène peuvent être causées par un rinçage excessif;
- Des carences en magnésium, surtout dans les substrats froids;
- Le sol est généralement pauvre;
- La vie dans le sol est inhibée.
Symptômes d’un pH trop élevé (substrat trop alcalin):
- La plupart des nutriments se dissolvent moins facilement, ce qui cause la précipitation des composés de calcium, de fer et de phosphore;
- Absorption réduite du manganèse, du phosphore et du fer, mais aussi du cuivre, du zinc et du bore. Cela cause des carences, surtout dans les substrats humides et froids;
- Dans les sols sablonneux, la dégradation des substances organiques augmente considérablement si le pH est trop élevé.
Qu’est-ce qui détermine le pH?
L’un des facteurs les plus importants de la valeur du pH d’une solution ou d’un substrat est la capacité de tamponnage. La capacité de tamponnage, dans ce cas, signifie qu’une sorte d’équilibre s’établit et se renouvelle constamment. Par exemple, si l’on verse une goutte d’acide dans un litre d’eau du robinet au pH de 7, la goutte aura peu d’effet sur l’acidité. Par contre, si l’on verse une goutte d’acide dans un litre d’eau déminéralisée (eau de batterie), le pH baissera immédiatement de façon dramatique. C’est parce que l’eau du robinet contient du bicarbonate, alors que l’eau déminéralisée n’en contient pas. Le bicarbonate est la substance de tamponnage la plus importance pour les valeurs de pH entre 5,5 et 7,5 dans l’eau4.
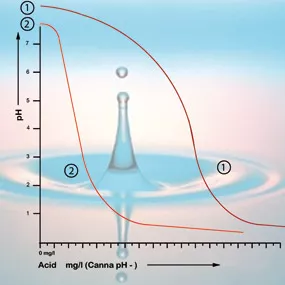
Le bicarbonate s’attache à l’acide dans la solution, ce qui dégage du dioxyde de carbone dans l’atmosphère. Le pH est donc neutralisé et les changements d’acidité seront mineurs, tant qu’il reste du bicarbonate.
À une valeur de pH de 5,3, tout le bicarbonate a été utilisé, et la solution n’a plus de tampon. Le pH est maintenant instable est changera immédiatement si on ajoute de l’acide (voir figure 2). La quantité d’acide requise pour que la solution nutritive ait un bon taux d’acidité peut donc être calculée selon le contenu en bicarbonate. Le contenu en bicarbonate de l’eau du robinet est généralement donné par l’entreprise d’approvisionnement en eau en milligrammes par litre5.
La capacité de tamponnage et l’acidité du substrat dépendent de sa composition et de sa fraîcheur. Le pH de l’eau du robinet est généralement déterminé par la présence de matières organiques, de calcium et de bicarbonate. L’argile contient toujours du carbonate de calcium et a une valeur de pH relativement élevée, qu’il est difficile de modifier, alors que la tourbe et les sols sablonneux sont acides6.
La plante elle-même influence grandement l’acidité. Selon le stade de développement, les nutriments disponibles, les écarts de température des racines et les écarts de l’intensité lumineuse, les racines sécréteront des substances acides ou alcalines. C’est pourquoi le pH du milieu racinaire peut fluctuer constamment. Un équilibre alimentaire sophistiqué durant les différentes phases de développement gardera le pH de l’environnement racinaire dans les valeurs acceptables.
La vie microscopique, le taux de CO2 et la croissance d’algues peuvent aussi avoir une incidence sur l’acidité du milieu racinaire et du réservoir de solutions nutritive7.
Mesurer le pH
Mesurer le pH est assez facile : vous aurez besoin d’indicateurs de pH, comme du papier tournesol ou une trousse d’analyse du pH. Ces méthodessont peu coûteuses, mais ne sont pas toujours précises et peuvent être erronées d’une ou de deux unités. Les pH-mètres sont généralement plus chers. Leur précision dépend du type d’instrument et de la calibration régulière avec un liquide de calibrage.
Échantillonnage

Le pH de l’eau d’arrosage des plantes est important, mais l’acidité autour des racines est essentielle. Quand vous mesurez le pH, il est donc très important de prendre correctement l’échantillon pour obtenir des résultats exacts. L’échantillon doit représenter l’acidité moyenne de l’environnement racinaire.
Dans un système fermé, il est facile de prendre des échantillons et de mesurer le pH: il suffit de mesurer la solution nutritive recirculée.
Dans les systèmes à substrats sans recirculation, la solution nutritive est tirée du substrat (laine de roche, mousse agricole) à divers endroits. Les experts discutent depuis toujours du meilleur endroit d’où tirer les échantillons. Comme nombre de laboratoires réputés, nous vous recommandons de prendre les échantillons des endroits où se trouvent les racines, c’est-à-dire sous les goutteurs et autour de ceux-ci. Prenez de petits échantillons d’autant d’endroits que possible. Prenez toujours les échantillons au même moment, idéalement après la seconde alimentation par les goutteurs durant le cycle de luminosité/jour.

En terreau, dans le coco et les substrats de tourbe, prenez une petite quantité de substrat à plusieurs endroits.
La meilleure façon de mesurer l’acidité de l’échantillon est d’utiliser la méthode "1:1,5 extraction du volume". Vous pouvez le faire vous-même en humidifiant le substrat tant que l’eau s’écoule entre vos doigts si vous le pétrissez et le pressez assez fort (photo 1). Utilisez par exemple un bécher de 250 ml. Versez-y 150 ml d’eau déminéralisée. Ajoutez le substrat jusqu’à atteindre un volume de 250 ml (photo 2). Mélangez bien et laissez reposer quelques heures. Ensuite, filtrez le mélange et mesurez le pH.
Les bonnes valeurs de pH pour chaque substrat
Lorsque vous cultivez en substrat, des valeurs de pH variant entre 5,0 et 6,4 conviennent au milieu racinaire. Si les valeurs sont légèrement trop basses ou trop élevées, il n’y aura pas de séquelles. Les effets dommageables ne se produiront qu’avec des valeurs inférieures à 4 ou supérieures à 8. Un pH de moins de 4 cause souvent des dommages immédiats aux racines. De plus, les métaux lourds comme le manganèse et le fer sont si bien absorbés qu’ils peuvent empoisonner la plante (nécrose). Un pH de 7 à 8 n’est pas immédiatement dommageable. Les nutriments comme le fer, le phosphore et le manganèse sont moins disponibles, ce qui causera des carences (chlorose et problème de développement) à long terme.
Corriger le pH
Si l’acidité du milieu racinaire se situe entre 5 et 6,4, le pH de votre environnement de culture est adéquat et vous n’avez pas à prendre de mesures correctives. Évitez d’ajuster le pH à moins que ce ne soit absolument nécessaire. La correction risque de faire plus de mal que de bien, car la plante chérit sa tranquillité. Il est plus important de surveiller les changements de l’acidité sur une période plus longue. Si sa valeur descend sous 5 ou augmente à plus de 6,4, il est conseillé de faire des ajustements graduels (voir figure 2).
La façon la plus facile de corriger l’acidité est de diminuer l’acidité de la solution nutritive à l’aide d’acide nitrique durant la phase de croissance et d’acide phosphorique durant la phase de floraison ou, au besoin, de l’augmenter à l’aide d’hydroxyde de potassium, de bicarbonate de potassium ou de soda8 et de CANNA Rhizotonic. Assurez-vous que le pH de la solution utilisée ne descend pas trop en deçà de 5,0. Les fibres de la laine de roche en seraient endommagées, ce qui causerait l’émission d’une grande quantité de matières alcalines à de très basses valeurs de pH. De plus, le pH est plus difficile à contrôler en l’absence de bicarbonate.
Un pH élevé dans le milieu racinaire peut également être causé par l’accumulation de bicarbonate. Pour y remédier, maintenez le drainage à 20% ou rincez le tout avec une solution plus acide.
Notez les mesures du pH de la solution ajoutée et de la solution nutritive dans le substrat. Cela vous donnera une idée de la progression du pH et de l’effet des mesures prises.
Notes
1. Les enzymes qui divisent les protéines ont besoin d’un environnement acide (jus gastriques), alors que les enzymes qui divisent les glucides requièrent un environnement alcalin (salive).
2.L’acidité d’une solution est déterminée par le rapport entre les ions d’hydrogène (acidité) et les ions d’hydroxyde (alcalinité).
3. Des manques peuvent se produire parce que la plante doit secréter des protons pour pouvoir absorber ces molécules. Un substrat au pH bas contient déjà une très grande quantité de protons. Ces éléments se font également lessiver, car les protons repoussent les molécules du médium dans le substrat.
4. Le bicarbonate est la substance qui donne le tartre lorsqu’elle est combinée au calcium. On utilise le bicarbonate avec le sodium dans les médicaments pour contrer l’acidité gastrique excessive (Alka-Seltzer).
5. Certains laboratoires travaillent également avec la dureté du bicarbonate. Afin de traduire cette valeur en mg/l de bicarbonate, vous devez multiplier la dureté du bicarbonate par 21,8. Par exemple, si la dureté du bicarbonate est de 11, alors un litre d’eau contient (11 x 21,8=) 240mg/litre de bicarbonate.
6.
| Sol sablonneux : | pâturage | pH 4.6 … 5.2 | terrain à bâtir | pH 5.0 … 5.6 |
|---|---|---|---|---|
| Argile: | argile de mer | pH 6.0 … 7.2 | argile de rivière | pH 6.2 … 6.4 |
| Tourbe: | naturelle | pH 4.0 |
7. Si la croissance d’algues est importante, le pH augmentera, car le dioxyde de carbone sera évacué de la solution. Les bactéries peuvent transformer certaines formes d’azote : elles ont donc un effet acidifiant. De grandes quantités de CO2 dans l’air génèrent plus de dioxyde de carbone dans la solution nutritive et vice versa.
8. N’utilisez que de petites quantités de soda, car il contient du sodium et les plantes ne requièrent qu’une infime quantité de sodium. Souvenez-vous que de fortes concentrations de sodium endommageront la plante.